Яйцеклетки впервые вырастили полностью "в пробирке" из клеток кожи грызуна
 Эти
мышки, одиннадцати месяцев от роду, появились на свет из яйцеклеток,
полученных целиком "в пробирке", а точнее в чашке Петри. Эти
мышки, одиннадцати месяцев от роду, появились на свет из яйцеклеток,
полученных целиком "в пробирке", а точнее в чашке Петри.
Женская половая клетка (ооцит, или яйцеклетка) в природе проходит
уникальные преобразования из клеток-предшественников, или
дифференциацию. Этот процесс делает её в итоге тотипотентной, то есть
способной дать начало любому клеточному организму путём деления.
Воспроизвести все эти преобразования "в пробирке", то есть вне живого
организма, невероятно сложно, и многие исследователи потерпели на полях
таких сражений неудачу. Но были и успешные работы.
Так, в 2012 году японский биолог, специализирующийся на стволовых клетках, Митинори Сайто (Mitinori Saitou) и его коллеги из Университета Киото путём последовательного перепрограммирования получили из
клеток кожи мыши сначала эмбриональные стволовые клетки, а потом
примордиальные зародышевые клетки, которые являются предшественниками
сперматозоидов и яйцеклеток. Но для того чтобы последние смогли
развиться в настоящие половые клетки, их было необходимо поместить в
организм живой мыши.
Следующим знаковым шагом стало как раз получение "в пробирке" полноценных яйцеклеток из примордиальных зародышевых клеток (мы рассказывали об этом исследовании). Сделать это удалось опять же японской команде из Токийского университета сельского хозяйства во главе с Яёи Обатой (Yayoi Obata), о чём они сообщили в июле 2016 года.
И вот, наконец, новая команда исследователей, возглавляемая
репродуктивным биологом Катсухико Хаяси (Katsuhiko Hayashi) из
Университета Кюсю в Фукуоке (Kyushu University),
в которую вошли и Обата с Сайто, прошла весь путь от клеток кожи до
яйцеклетки вне организма животного. Результаты этого исследования, опубликованные в издании Nature, можно считать настоящим прорывом в репродуктивной биологии и регенеративной медицине.
В ходе своей работы учёные создали полноценные ооциты из
эмбриональных стволовых клеток и из индуцированных плюрипотентных
стволовых клеток, полученных в свою очередь из эмбриональных фибробластов, а также из фибробластов кончика хвоста взрослой мыши.
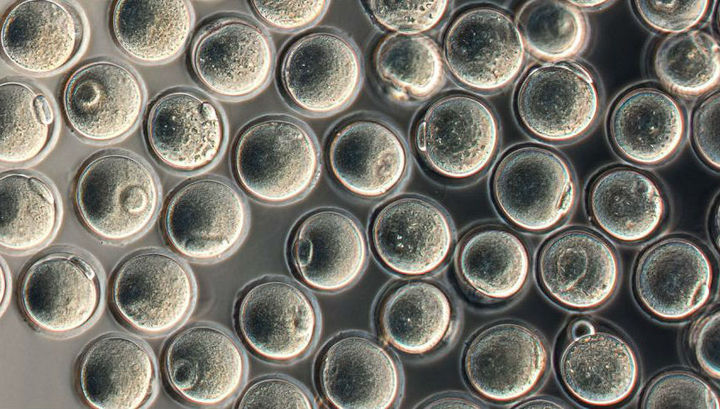
На стадии получения клеток-предшественников ооцитов их помещали в
кластеры клеток, взятых из яичников эмбрионов, затем их культивировали
на протяжении месяца, создавая максимально близкую к природной среду.
Несмотря на то, что сама процедура получения полноценных яйцеклеток
технически очень сложна, исследователи считают, что она достаточно
надёжна. Для того чтобы в этом убедиться, одинаковые эксперименты были
проведены разными группами учёных, и их результаты были идентичны.
Из каждого клеточного кластера было получено около 50 полноценных
ооцитов. Среди них наблюдался более высокий процент хромосомных
аномалий, чем в природе, но 75% яйцеклеток имели правильное число
хромосом.
На следующем этапе некоторое количество ооцитов было искусственно
оплодотворено, из них было получено около 300 двухклеточных эмбрионов,
которые были имплантированы в тело самок грызунов. Только 11 из них
превратились в доношенных мышат, что составляет примерно 3,5% от общего
числа исходных зародышей. Для сравнения, успех искусственного
оплодотворения яйцеклеток, взятых из организма взрослой мыши, составляет
62%. Причину столь низкой эффективности авторы работы пока назвать не
могут, но сам факт успеха даже в столь малом числе случаев поражает и
обнадёживает.
При этом все выжившие мышата превратились в полноценных взрослых
особей, способных произвести своё собственное потомство. Более того, у
этих счастливчиков были отобраны плюрипотентные стволовые клетки,
которые снова запустили в цикл искусственного получения ооцитов.
Что же касается человеческих яйцеклеток, то, по словам авторов, для
перенесения техники от мышиной модели к человеку потребуется не менее 10
лет, не говоря о том, что сам этот метод нуждается в доработке.
Но группа Хаяси и не собирается этого делать, поскольку в Японии
категорически запрещены подобные манипуляции даже в научных целях. При
этом исследователи сильно сомневаются, что полученные ооциты сразу будут
достаточно высокого качества, чтобы быть пригодными для лечения
бесплодия. Так что у широкой общественности есть ещё много времени,
чтобы обсудить все этические стороны вопроса, включая возможность
получения потомства без участия биологической матери.
Стоит отметить, что японские исследователи – не единственные, кто
озабочен получением половых клеток "в пробирке". Так, недавно команда
учёных из Китая сообщила о создании искусственных
клеток-предшественников сперматозоидов, или сперматид, с помощью которых позднее было получено здоровое потомство.
Работы также ведутся и с половыми клетками человека. Всего через два
года после успеха Сайто израильский биолог Джейкоб Ханна (Jacob Hanna)
из Института Вейцмана и его коллеги искусственно получили примордиальные
зародышевые клетки. По этическим причинам они не стали имплантировать
их в организм человека. Тем не менее исследователи крайне заинтересованы
результатами японских коллег и рассчитывают на продолжение своей работы
в новом ключе. Среди прочего им предстоит решить очень важную задачу, а
именно найти, чем заменить зародышевые клеточные кластеры.
http://www.vesti.ru/doc.ht...
Источник: cont.ws.
Рейтинг публикации:
|














