Нобелевская премия по химии 2008 года присуждена за открытие зелёного флуоресцирующего белка и за разработку новых методов исследований на его основе. Премию в равных долях поделили американские исследователи Осаму Шимомура, Мартин Чалфи и Роджер Циен. Сегодня флуоресцирующие белки используются в качестве светящихся меток при изучении клеток, тканей и живых организмов.
  
Осаму Шимомура (Osamu Shimomura) из Лаборатории морской биологии (Marine Biological Laboratory) в Вудс-Хоуле (Массачусетс).
Мартин Чалфи (Martin Chalfie) из Колумбийского университета продемонстрировал возможность использования GFP в качестве флуоресцирующей генетической метки для исследования различных биологических явлений
Роджер Циен (Roger Y. Tsien) из Калифорнийского университета в Сан-Диего внёс вклад в понимание природы флуоресценции GFP.
Зелёный флуоресцирующий белок (green fluorescent protein, GFP) впервые обнаружили в 1962 году в организме медузы Aequorea victoria. Тогда никто не подозревал, что спустя десятилетия GFP из медузы и флуоресцирующие белки из других морских животных станут важнейшим инструментом в биологических и медицинских исследованиях.
А началась эта история так. В 1960 году уроженец Японии Осаму Шимомура, успешно начавший изучение биолюминесценции морских моллюсков в университете Нагоя, получил приглашение на работу в лабораторию Франка Джонсона в Принстоне, престижном американском университете. Объектом его исследований стала небольшая медуза из рода экворея, обитающая в северной части Тихого океана.
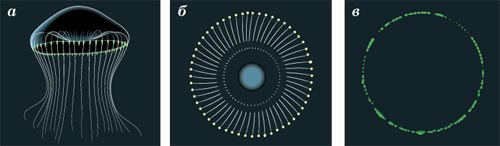
В спокойном состоянии эта медуза бесцветна, а в ответ на раздражение края её «зонтика» начинают светиться зеленоватым светом. Вначале Шимомура выделил из эквореи люминесцентный белок, получивший название «экворин». Экворин обладает способностью к свечению только в присутствии ионов кальция, а источником энергии служит химическая реакция окисления целентеразина - низкомолекулярного вещества, соединённого с экворином в комплекс.
Шимомура и Джонсон обратили внимание на то, что в лабораторных условиях экворин испускает синий свет, хотя у живой медузы свечение зелёное. Оказалось, что в клетках эквореи есть ещё один удивительный белок: если его облучить синим или ультрафиолетовым светом, он даёт зелёное свечение (флуоресценцию).
Зелёный флуоресцирующий белок состоит из 238 аминокислот. Аминокислотная цепочка свёрнута в форме «бочки». Внутри расположена хромофорная группа, которая поглощает синий свет, а излучает зелёный.
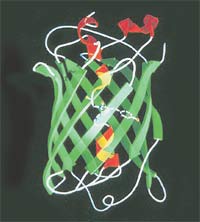
Этот белок и получил впоследствии название GFP. В организме медузы происходит безызлучательный перенос энергии синего света от экворина к находящейся рядом молекуле GFP, которая и преобразует её в зеленоватое свечение.
В конце 1970-х годов Шимомура смог установить природу хромофора - той химической группы в составе зелёного флуоресцирующего белка, которая поглощает и испускает свет. Свечение GFP, в отличие от экворина и других белков, участвующих в биолюминесценции, не связано с химическими реакциями: он светится в ответ на облучение синим или ультрафиолетовым светом. Именно способность к флуоресценции и легла в основу последующего использования GFP в качестве светящейся белковой метки, которая может сделать видимыми процессы в живых клетках.
Однако, чтобы широкое применение зелёного флуоресцирующего белка стало возможным, требовалось решить важную задачу - выделить ген, кодирующий GFP. Первым это сделал американский биохимик Дуглас Прашер. В 1985 году он клонировал ген экворина, а затем в 1987 году, получив небольшой грант на исследование, приступил к определению нуклеотидной последовательности зелёного флуоресцирующего белка. В 1992 году работа по клонированию гена GFP была завершена. Однако в Океанологическом институте в Массачусетсе, где в то время трудился Прашер, генетические исследования считались непрофильными. Специалисты по биолюминесценции особого интереса к ним не проявляли, а финансирование по гранту к тому времени давно закончилось. В итоге Прашер, опубликовав результаты в престижном научном издании «Gene», был вынужден прекратить эксперименты. Образцы полученной им генетической конструкции GFP он безвозмездно передал другим исследователям, в том числе Мартину Чалфи и Роджеру Циену. Осуществить блестящую идею сшивки гена флуоресцирующего белка и гена любого другого белка Прашеру не удалось. Вскоре ему пришлось перейти в институт с другой тематикой, а затем и вовсе бросить науку. Сейчас Прашер работает водителем в фирме, продающей автомобили, в городке Хантсвилль штата Алабама. На присуждение премии его коллегам Прашер отреагировал с юмором: «Если нобелевские лауреаты соберутся к нам в Хантсвилль, пусть пригласят меня на обед».
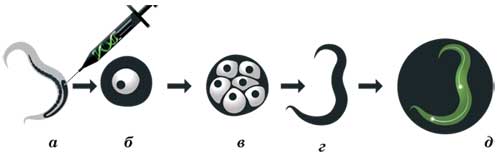
Используя ДНК-технологии, Чалфи встроил ген зелёного флуоресцирующего белка в генный переключатель, запускающий работу шести рецепторных нейронов нематоды C.elegans.
Разработка практического применения GFP в качестве светящейся метки связана с именем второго нобелевского лауреата - Мартина Чалфи, профессора Колумбийского университета. Он впервые узнал о существовании зелёного флуоресцирующего белка в 1988 году, на семинаре по биолюминесценции, проводившемся в университете. У Чалфи возникла идея использовать GFP как индикатор при исследованиях круглого червя-нематоды Caenorhabditis elegans (этот маленький прозрачный червячок был любимым объектом экспериментов Сидни Бреннера, лауреата Нобелевской премии 2002 года). В 1992 году, попросив у Прашера клонированный ген зелёного флуоресцирующего белка, Чалфи поручил своей аспирантке Гайе Юскирхен внедрить его в геном кишечной палочки Escherichia coli. Вскоре работа была успешно выполнена - во флуоресцентном микроскопе бактерии светились зелёным светом. Теперь учёные не только имели зелёный флуоресцирующий белок в достаточном количестве для дальнейших исследований, но и могли широко экспериментировать с внедрением его в другие организмы. В 1994 году Чалфи осуществил задуманное - встроил ген GFP в определённые участки генома нематоды C. elegans. В результате у потомства нематоды нейроны стали светиться зелёным светом, как «зонтик» у медузы. Так учёные получили возможность наблюдать работу рецепторных нейронов живого организма.
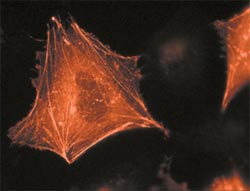
Клеточный белок актин, меченный красным флуоресцирующим белком (RFP), выглядит под флуоресцентным микроскопом как изящная пирамидка.
Третий нобелевский лауреат - Роджер Циен из Калифорнийского университета в Сан-Диего получил Нобелевскую премию за то, что смог более детально разобраться в механизме флуоресценции GFP и в 1996 году синтезировать его разновидности, которые светятся в голубой, циановой и жёлтой областях спектра. Более того, в 1997 году работавший тогда в лаборатории Циена японский исследователь Атсуси Мияваки на основе цианового и жёлтого флуоресцирующих белков создал первый генетически кодируемый биосенсор на кальций.
Сейчас в распоряжении исследователей имеется большой набор разных флуоресцирующих генетически кодируемых маркеров и молекулярных биосенсоров, которые можно одновременно использовать для изучения процессов, происходящих с живыми клетками и отдельными внутриклеточными белками. Эта гамма светящихся белков была бы неполной без исследований Сергея Лукьянова из Института биоорганической химии РАН. Начиная с 1999 года его лаборатория открыла целое семейство GFP-подобных белков, которые светятся в жёлтой, красной и дальнекрасной областях. Причём выделены эти белки из морских кораллов, которые, в отличие от медузы эквореи, способностью к биолюминесценции не обладают.
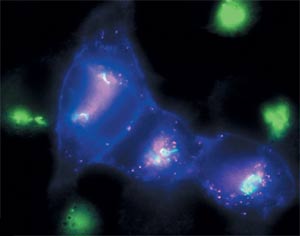 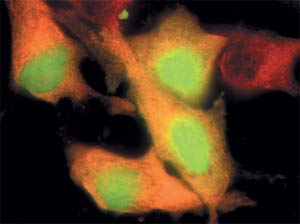
Только что синтезированный в клетке рецепторный белок LAMP2 светится голубым, аппарат Гольджи - зелёным, а старые, давно появившиеся «на свет» рецепторные белки дают красную флуоресценцию.
Внутри клетки на фоне зелёного свечения клеточной цитоплазмы видны красные нити белка тубулина.
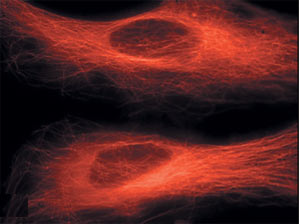
Изящные облака тубулина светятся в флуоресцентном микроскопе красным светом
Флуоресцирующие белки совершили настоящий переворот в исследованиях живых клеток. С их помощью можно проследить, как в экспериментах идёт синтез белков, как формируются нейронные связи, как развивается эмбрион и многое-многое другое.
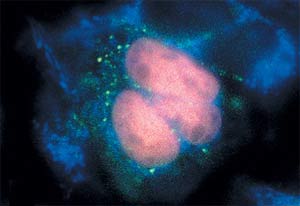
Белок, синтезирующийся в ядре клетки, светится красным на фоне слабой зеленовато-голубой флуоресценции самих клеток.
Комментарий специалиста
КЛЕТОЧНАЯ БИОЛОГИЯ В НОВОМ СВЕТЕ
Кандидат химических наук В. ВЕРХУША, руководитель лаборатории и профессор кафедры анатомии и структурной биологии Медицинского колледжа им. Альберта Эйнштейна (г. Нью-Йорк, США).
Самый большой вклад флуоресцирующие белки внесли в клеточную биологию. До открытия зелёного флуоресцирующего белка учёные могли получать изображения мёртвых клеток, окрашенных искусственными красителями. GFP и более современные разноцветные белки позволили фотографировать живую клетку в движении (перемещении) и развитии.
Почему только после открытия GFP стало возможно «увидеть», как работают белковые молекулы в живых клетках и тканях организма?
Во-первых, в отличие от других флуоресцентных меток, GFP-подобным белкам для свечения не нужны никакие вспомогательные вещества, кроме молекулярного кислорода, поэтому клетка остаётся живой и неповреждённой.
Во-вторых, в отличие от других красителей, GFP - это белковая молекула, которая синтезируется в клетке по своему генетическому коду. А современные методы генной инженерии позволяют «сшить» ген любого белка с геном флуоресцирующего белка, а затем внести эту генетическую «химеру» в клетку или модельный организм. Такая генетически модифицированная клетка начинает синтезировать сложный «химерный» белок, содержащий светящуюся белковую молекулу.
В-третьих, молекула флуоресцирующего белка достаточно маленькая и поэтому практически не влияет на своего «партнёра». Это означает, что вся сложная белковая конструкция выполняет те же функции, что и сам белок без флуоресцентной метки.
К примеру, фермент после генетической «сшивки» с флуоресцирующим белком остаётся тем же самым ферментом, но с одним очень важным отличием - он становится видимым под флуоресцентным микроскопом. Теперь можно посмотреть, где находится этот фермент в живой клетке, как он перемещается из одной клеточной структуры в другую, как меняется его количество под воздействием каких-либо лекарственных веществ и т.д.
Флуоресцирующие белки позволяют изучать локализацию белков внутри клетки или их достаточно медленные (в течение минут) перемещения. Чтобы изучить очень быстрые (с временным разрешением до сотен миллисекунд) движения белков, современные исследователи пошли дальше, чем нобелевские лауреаты, и создали фотоактивируемые флуоресцирующие белки. Исходно такой белок либо вообще не флуоресцирует, либо флуоресцирует одним цветом. После облучения коротким импульсом лазера фотоактивируемый белок либо становится флуоресцентным, либо меняет свет флуоресценции. Выполнив серию снимков, можно проследить за распространением «химерной» белковой конструкции из области лазерного облучения в другие части клетки. Использование фотоактивируемых белков в сочетании с многолазерными микроскопами и новейшими методами обработки изображения позволяет получать снимки клеток и внутриклеточных структур с пространственным разрешением на порядок выше (то есть 15-25 нанометров), чем в классической оптике.
Созданием фотоактивируемых флуоресцирующих белков, в частности, занимается лаборатория Сергея Лукьянова в Институте биоорганической химии РАН, в которой открыли первый красный флуоресцирующий белок. История этого открытия такова. К 1999 году в области разработки и синтеза флуоресцирующих белков наметился застой. Несмотря на огромные усилия и достаточное финансирование, учёным не удавалось синтезировать варианты GFP, светящиеся в оранжевой и красной областях. Без этого невозможно наблюдать за функционированием нескольких белков одновременно.
В это время Михаил Матц в лаборатории Лукьянова и Юлий Лабас из Института экологии и эволюции РАН предположили, что интенсивная окраска кораллов и их флуоресцирующее свечение в ультрафиолете могут быть связаны с наличием в них GFP-подобных белков. К проверке этой смелой гипотезы подключилась вся лаборатория, и вскоре был клонирован ген первого красного флуоресцирующего белка, названного DsRed. Впервые было показано, что флуоресцирующие белки достаточно широко распространены в морских организмах. Открытие группы Лукьянова вызвало целый вал научных публикаций. К настоящему времени учёные по всему миру клонировали более 200 генов различных флуоресцирующих белков из морских организмов. Количество же существующих генетических модификаций этих белков на порядок больше.
За 15 лет активных исследований полезные свойства GFP-подобных белков были многократно усилены. Учёные создают новые формы GFP-подобных белков со спектрами флуоресценции в дальнекрасной области, где собственная фоновая флуоресценция тканей и клеток, обычно мешающая получению хороших изображений, минимальна. С открытием жёлто-оранжевых, красных и дальнекрасных белков стало возможным наблюдать до пяти «химерных» белковых конструкций в клетке одновременно. В сочетании с новыми так называемыми двухфотонными микроскопами, лазерный свет которых проникает на глубину до нескольких миллиметров, дальнекрасные белки позволят делать снимки клеток и внутриклеточных структур не только на поверхности, но и внутри живой ткани. Учёные работают также над созданием новых молекулярных флуоресцирующих биосенсоров, позволяющих количественно измерять в клетках активность ферментов, концентрацию различных клеточных метаболитов, взаимодействие между внутриклеточными белками и многое другое.
Светящиеся белки, безусловно, ожидает большое будущее.
Литература
Информация Нобелевского комитета www.nobelprize.org
Лабас Ю. А., Гордеева А. В., Фрадков А. Ф. Флуоресцирующие и цветные белки // Природа, 2003, № 3.
Pieribone V., Gruber D. F., S. Nasar. Aglow in the Dark: The Revolutionary Science of Biofluorescence. - Harvard University Press, 2005.
Степаненко О. В., Верхуша В. В., Кузнецова И. М., Туроверов К. К. Флуоресцентные белки: физико-химические свойства и использование в клеточной биологии // Цитология, 2007, т. 49, № 5, с. 395-420.
Кандидат физико-математических наук Е. ЛОЗОВСКАЯ
"Наука и жизнь"
Рейтинг публикации:
|
























Статус: |
Группа: Гости
публикаций 0
комментариев 0
Рейтинг поста:
Статус:
Группа: Посетители
публикаций 0
комментариев 528
Рейтинг поста:
Статус: |
Группа: Гости
публикаций 0
комментариев 0
Рейтинг поста:
Но, что мне показалось интересным. Совпадение, как мне кажется, узора клеток и процессов в них происходящих с процессами, зафиксированными телескопом Хаблл, происходящими в далеких звездных галактиках. Пусть это будет совпадения или подгонка фотографического способа отражения объективной реальности под видение мира человеком, но как-то было упоминание в материалах проекта CNL - 000/1, о том, чтобы обратили внимание на схожесть биологической клетки и галактики по виду и сути тех процессов, которые в них протекают.
Сравните: