Ученые МГУ нашли способ остановить болезнь Альцгеймера на ранней стадии
МОСКВА, 17 июл — РИА Новости. Сотрудники факультета фундаментальной
медицины МГУ определили структуру пептидного комплекса, который
образуется в мозге на ранних стадиях развития болезни Альцгеймера.
Результаты исследования помогут в разработке соединений, способных
останавливать развитие болезни. Работа выполнена при поддержке
Российского научного фонда, ее результаты опубликованы в престижном
журнале Angewandte Chemie.
На ранних стадиях болезни
Альцгеймера в мозге людей образуются скопления бета-амилоидного пептида.
Научная группа из МГУ под руководством доктора химических наук
Владимира Польшакова изучала молекулярные механизмы агрегации
бета-амилоида у носителей тайваньской мутации, описала структуру
образующихся комплексов и установила роль ионов цинка (Zn2+) в их
формировании.
Бета-амилоид — это небольшой пептид, который
выполняет важные физиологические функции, например, защищает мозг от
потенциальных патогенов. После выполнения своих функций в норме пептид
разрезается протеазами и утилизируется. Однако в некоторых случаях
молекулы этого пептида начинают связываться друг с другом, образуя
сложные комплексы, токсичные для нейронов.
В течение нескольких
лет ученые МГУ в сотрудничестве с коллегами из Института молекулярной
биологии РАН им. В. А. Энгельгардта исследовали молекулярный механизм
цинк-зависимой агрегации бета-амилоидного пептида. В качестве модельного
объекта они выбрали пептид с тайваньской мутацией. У носителей подобных
мутаций болезнь Альцгеймера развивается в сравнительно молодом
возрасте. Авторы обнаружили, что структура бета-амилоидных комплексов из
мутантных пептидов оказывается более прочной и стабильной, чем у
комплексов из нормальных пептидов. Ключевую роль в их образовании играют
ионы цинка (Zn2+).
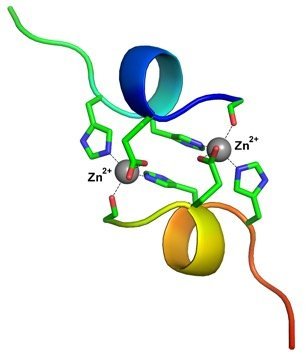
Структура комплекса фрагмента бета-амилоида - продукта тайваньской мутации, с ионами цинка.
"К
нашему удивлению, взаимодействие фрагмента этого пептида с ионами цинка
привело к образованию стабильного комплекса, в котором две пептидные
цепи оказались прочно скреплены двумя ионами цинка. Подобные биядерные
структуры ранее не были описаны в мировой литературе, — комментирует
Владимир Польшаков. — Важно отметить, что взаимодействие ионов металлов с
бета-амилоидом обычно приводит к множеству разных конформаций пептидной
цепи. Образующийся комплекс как бы "дышит", переходя от одной
конформации к другой. В случае же с продуктом тайваньской мутации
наблюдалась единственная конформация, позволившая нам с высокой
точностью определить ее структуру методами ядерного магнитного
резонанса".
Полученные результаты помогут в разработке соединений,
способных блокировать цинк-зависимую агрегацию бета-амилоида и, тем
самым, останавливать развитие болезни Альцгеймера на ранних этапах.
На
основании подтвержденного в данной работе молекулярного механизма
инициирования патогенной агрегации бета-амилоида уже запатентовано два
соединения, способные блокировать процессы агрегации бета-амилоидного
пептида. Изучение свойств этих соединений на животных моделях показало,
что они в несколько раз уменьшают риск развития заболевания,
соответствующего болезни Альцгеймера.
Сотрудники лаборатории
магнитной томографии и спектроскопии факультета фундаментальной медицины
МГУ выполняли исследование в сотрудничестве с научной группой из
Института молекулярной биологии РАН им. В. А. Энгельгардта (ИМБ РАН) под
руководством академика Александра Макарова.
Источник: https://ria.ru/science/2017071...
Рейтинг публикации:
|