CRISPR-редактирование победило мутации, приводящие к муковисцидозу
6-10-2019, 03:13. Разместил: Swarm
Одна из новейших CRISPR-нуклеаз успешно исправила две мутации в гене CFTR, приводящие к образованию новых сайтов сплайсинга и вызывающие муковисцидоз. Эксперименты проводились на клетках в культуре и органоидах.
Мутации в гене трансмембранного белка CFTR приводят к нарушению функций легких и поджелудочной железы. Credit: ellepigrafica | Shutterstock.com
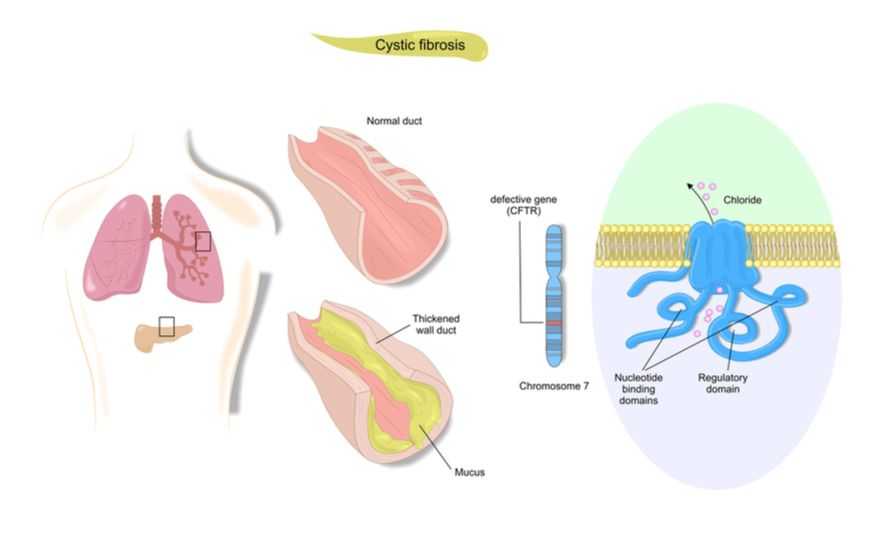
Муковисцидоз — наследственное заболевание, вызванное мутациями в гене CFTR (сystic fibrosis transmembrane conductance regulator, регулятор трансмембранной проводимости при муковисцидозе). Мутации приводят к неправильному сворачиванию белка и, соответственно, к потере его активности. Белок CFTR — канал для ионов хлора, и его дефект меняет баланс внутри- и внеклеточной жидкости. Главные последствия — повышение вязкости секрета в дыхательных путях и секреторная недостаточность пищеварительной системы. Несмотря на интерес ученых к этому заболеванию и многие перспективные работы, вылечить муковисцидоз пока невозможно, медицинское вмешательство сводится к устранению симптомов.
Ученые факультета клеточной, вычислительной и интегративной биологии Университета Тренто (Италия) попробовали исправить две мутации в гене CFTR: 3272-26A>G, вызывающую появление нового акцепторного сайта сплайсинга (означающего 3’-конец интрона), и мутацию 3849+10kbC>T, приводящую к появлению нового донорного сайта сплайсинга (5’-конец). Для этого редактирования использовали доставляемую при помощи лентивирусного вектора высокоспецифичную CRISPR-нуклеазу AsCas12a, полученную из Acidaminococcus sp. BV3L6. Она вносила небольшие делеции, устраняя таким образом возникшие сайты. Редактирование проводили на клетках разных типов, включая первичные эпителиальные клетки дыхательных путей пациентов и кишечные органоиды. Точность оказалась очень высокой: не было зафиксировано ни одного случая неспецифичного редактирования генома, система успешно различала мутантный аллель и аллель дикого типа. Потенциальная терапевтическая эффективность, оцененная в экспериментах с органоидами, была на уровне самого современного метода генной терапии муковисцидоза — доставки здоровой кДНК гена CFTR в пораженные органы. Эффективность же редактирования была значительно выше, чем у широко применяемой CRISPR-нуклеазы Streptococcus pyogenes SpCas9, которую ранее неоднократно использовали в экспериментах для исправления самой распространенной мутации при муковисцидозе — ΔF508.
Таким образом, исследователям удалось добиться перманентного восстановления нормальной активности CFTR без побочных эффектов. Современные методы борьбы с муковисцидозом не могут похвастаться ни тем, ни другим. Однако говорить о победе над болезнью рано. Методика, описанная в статье, может нейтрализовать лишь мутации, нарушающие сплайсинг (которых среди вызывающих муковисцидоз мутаций меньшинство), поскольку ее цель — удаление аберрантных сайтов сплайсинга, а не исправление мутантной последовательности.
Источник
Giulia Maule, et al. // Allele specific repair of splicing mutations in cystic fibrosis through AsCas12a genome editing // Nature Communications, 2019; DOI: 10.1038/s41467-019-11454-9
Вернуться назад